Los gases ideales, también conocidos como gases perfectos, son lo que cumplen con los postulados de la Teoría Cinético Molecular. La mayor parte de los gases a temperatura ambiente y a la presión atmosférica se comportan como gases ideales.
Ecuación de estado de los gases ideales
Esta ecuación se aplica para una masa de gas finita donde el gas puede estar sujeto a cambios de presión, volumen o temperatura absoluta (P, V, T).
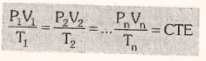
Procesos restringidos
Ley de Charles (Proceso Isobárico)
Para una misma masa de gas y a presión constante, los cambios de volumen y temperatura absoluta son directamente proporcionales.

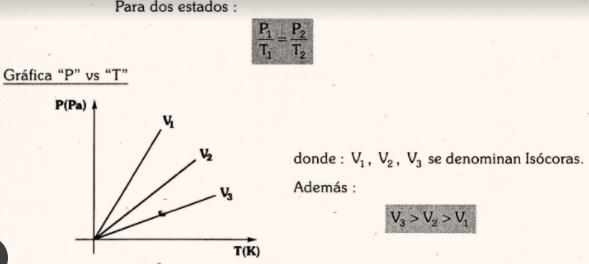
Ley de Gay-Lussac (Proceso Isócoro)
Para una misma masa de gas y a volumen constante, la variación de la presión y temperatura absoluta son directamente proporcionales.
Ley de Boyle-Mariotte (Proceso Isotérmico)
Para una misma masa de gas y a temperatura constante, los cambios de presión y volumen son inversamente proporcionales.

Proceso Adiabático
Es en que que no existe transferencia de calor (ΔQ=0) y se cumple para dos estados:

Ejemplos
1.- Un gas ocupa un volumen de 50 litros cuando su temperatura es de 25°C y su presión de 3 atm. Encontrar su volumen si su temperatura se reduce a -13°C sin alterar su presión.
Solución
Datos:
V1 = 50 litros, T1 = 25°C-273 = 298K, V2 = ?, T2 = -13°C+273 = 260K
Por ser un proceso Isobárico (presión constante), se aplica la Ley de Charles:
(V1/T1)=(V2/T2) 50/273=V2/260
Entonces, V2 = 47.61 litros
2.- Una botella de oxígeno contiene 10 m3 de gas a 0°C y a la presión de 2.73 atm. ¿Qué presión se ejerce cuando se calienta hasta 40°C?

3.- Se tiene una cierta cantidad de gas ideal de un cilindro que no permite la entrada ni la salida de calor (proceso adiabático). La presión inicial del gas es P1 = 105 Pa. Se conoce que la relación de los volúmenes V1/V2 = 100. Hallar la presión final P2.

Referencia: Termodinámica, teoría y problemas. Ing. Alejandro Vera Lázaro





ejercico 1
v2= 43.624 L
hay un error usaste 273 es vez de 298