La energía puede cruzar la frontera de un sistema cerrado en dos formas distintas: calor y trabajo. Es muy importante distinguir entre esas dos formas de energía, por lo que primero se deben analizar con el propósito de conformar una base sólida para el desarrollo de las leyes de la termodinámica.
Cuando un cuerpo se coloca en un medio que se encuentra a temperatura diferente, la transferencia de energía tiene lugar entre el cuerpo y el medio hasta que se establece el equilibrio térmico, es decir, cuando ambos alcanzan la misma temperatura.
La dirección de la transferencia de energía es siempre del cuerpo con la mayor temperatura al de menor temperatura. Una vez establecida la igualdad de temperatura, termina la transferencia de energía. En este proceso se afirma que la energía se transfiere en forma de calor.
El calor puede definirse como la forma de energía que se transfiere entre dos sistemas (o entre un sistema y el exterior) debido a una diferencia de temperatura. Es decir, una interacción de energía será calor sólo si ocurre debido a una diferencia de temperatura. Entonces, se deduce que no puede haber ninguna transferencia de calor entre dos sistemas que se encuentran a la misma temperatura.
En termodinámica, el término calor significa simplemente transferencia de calor.
Un proceso durante el cual no existe transferencia de calor, se denomina proceso adiabático. El término adiabático proviene de la palabra griega adiabatos, que significa «no pasar». Existen dos maneras en que un proceso puede ser adiabático: el sistema se encuentra aislado de forma que sólo una cantidad insignificante de calor cruce la frontera, o bien, tanto el sistema como el exterior están a la misma temperatura y por lo tanto no existe fuerza impulsora para la transferencia de calor.
Se debe distinguir entre un proceso adiabático y uno isotérmico. Aunque no hay transferencia de calor durante un proceso adiabático, otros medios como el trabajo pueden cambiar el contenido de energía, y como consecuencia, la temperatura de un sistema.
Como forma de energía, el calor tiene unidades de energía, la más común es el kJ (o Btu). La cantidad de calor transferida durante el proceso entre dos estados (1 y 2) se denota mediante Q12 o solo Q. La transferencia de calor de un sistema por unidad de masa se denota como q y se determina a partir de:
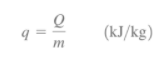
En algunas ocasiones, es necesario conocer la tasa de transferencia de calor (cantidad de calor transferida por unidad de tiempo) en lugar del calor total transferido durante cierto intervalo de tiempo. La tasa de transferencia de calor se expresa con Q̇, donde el punto significa la derivada con respecto al tiempo, o «por unidad de tiempo».
La tasa de transferencia de calor Q̇ tiene las unidades kJ/s, equivalente a kW. Cuando Q̇ varía con el tiempo, la cantidad de transferencia de calor durante un proceso se determina integrando Q̇ sobre el intervalo de tiempo del proceso:
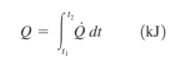
Cuando Q̇ permanece constante durante un proceso, esta relación se reduce a:
Q = Q̇ Δt (kJ)
Donde Δt = t2-t1 es el intervalo de tiempo en el que ocurre el proceso.
Antecedentes históricos del calor
A mediados del siglo XIX, se llegó a una verdadera comprensión física sobre la naturaleza del calor, gracias al desarrollo en ese tiempo de la teoría cinética, misma que considera a las moléculas como diminutas esferas que se encuentran en movimiento y que por lo tanto, poseen energía cinética.
De esta forma, el calor se define como la energía relacionada con el movimiento aleatorio de átomos y moléculas. A pesar de que entre el siglo XVII y principios del XIX se sugirió que el calor es la manifestación del movimiento a nivel molecular, la opinión prevaleciente sobre el calor hasta la mitad del siglo XIX se basó en la teoría calórica propuesta en 1978 por el químico francés, Antoine Lavoisier.
Esta teoría sostiene que el calor es una sustancia llamada calórico similar a un fluido que no tiene masa, es incoloro, inodoro e insípido, y puede pasar de un cuerpo a otro. Cuando se añadía calórico a un cuerpo, se incrementaba su temperatura, cuando se extraía, disminuía.
Cuando un cuerpo ya no podía contener más calórico, de forma parecida a cuando en un vaso con agua ya no es posible disolver más sal o azúcar, se decía que el cuerpo estaba saturado con calórico. Esta interpretación dio lugar a los términos líquido saturado y vapor saturado que aún se utilizan en la actualidad.
La teoría del calórico experimentó críticas inmediatamente después de su introducción. Sostenía que el calor es una sustancia que no podía ser creada ni destruida; sin embargo, se sabía que el calor podía ser generado de modo indefinido a frotar entre sí las manos o dos trozos de madera.
En 1978, el estadounidense Benjamin Thompson (conde Rumford), demostró en sus artículos que el calor se genera en forma continua por rozamiento. Muchos otros científicos pusieron en duda la validez de la teoría del calórico, pero fueron los cuidadosos experimentos del inglés James P. Joule publicados en 1843, los que finalmente convencieron a los escépticos de que el calor no era una sustancia, así que se desechó la teoría del calórico.
A pesar de ser abandonada por completo a mediados del siglo XIX, la teoría contribuyó en gran medida al desarrollo de la termodinámica y la transferencia de calor.
El calor se transfiere mediante tres mecanismos: conducción, convección y radiación. La conducción es la transferencia de energía de las partículas más energéticas de una sustancia a las adyacentes menos energéticas, como resultado de la interacción entre partículas.
La convección es la transferencia de energía entre una superficie sólida y el fluido adyacente que se encuentra en movimiento, y tiene que ver con los efectos combinados de la conducción y el movimiento del fluido.
La radiación es la transferencia de energía debida a la emisión de ondas electromagnéticas o fotones.
Fuente de información: Termodinámica. Yunes A. Cengel, Michael A. Boles. 7° edición.




